유전자 재조합
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유전자 재조합은 유성 생식을 하는 생물의 생식 세포에서 염색체의 유전자 교차를 통해 유전자가 재배열되는 현상을 의미한다. 이는 유전적 변이를 증가시키며, 유전학적 지도 작성에 활용된다. 또한, 상동 재조합과 비상동 말단 연결과 같은 다양한 방식으로 발생하며, 세균, 면역계, RNA 바이러스 등 다양한 생명체에서 중요한 역할을 한다. 유전자 재조합 기술은 재조합 DNA를 생성하여 생명공학, 의학, 농업 등 다양한 분야에서 활용되며, 제한 효소 매개 통합, 깁슨 어셈블리, 골든 게이트 클로닝 등이 그 예시이다.
더 읽어볼만한 페이지
- 유전 정보 수정 - 형질전환
형질전환은 세균, 효모, 식물, 동물 등 생명체에 외부 DNA를 도입하여 유전적 형질을 변화시키는 기술이며, 자연적 또는 인공적으로 발생하며 유전자 조작에 활용된다. - 유전 정보 수정 - 염색체 전좌
염색체 전좌는 염색체 일부 또는 전체가 다른 염색체로 이동하는 구조 변화로, 유전 정보 변화를 초래하여 다양한 질병을 유발하며, 상호 전좌, 비상호 전좌, 로버트슨 전좌 등으로 분류되고, 가족력이 있는 경우 유전자 검사가 중요하다. - 유전공학 - CRISPR
CRISPR은 세균과 고세균이 외래 유전 물질로부터 자신을 방어하는 적응 면역 시스템으로, CRISPR-Cas9 시스템은 유전자 편집 기술로 발전하여 노벨 화학상을 수상했으며, 유전 질환 치료, 농업 등 다양한 분야에 활용될 잠재력을 지닌다. - 유전공학 - 유전자 변형 식품
유전자 변형 식품은 유전 공학적 방법으로 DNA를 변형한 유기체에서 생산되는 식품으로, 식량 생산 증대와 영양 강화 등의 목적으로 사용되지만 안전성과 환경 영향에 대한 논쟁이 존재하며 국가별로 규제가 다르다. - 세포 과정 - 감수분열
감수분열은 유성생식을 하는 생물에서 배우자를 형성하는 세포분열 과정으로, 염색체 수를 줄여 유전적 다양성을 확보하며, 감수분열 I과 II 두 단계로 구성되어 상동염색체 및 자매염색분체 분리, 독립적 분리 및 교차를 통해 유전적 다양성을 증가시키지만, 염색체 비분리 오류는 염색체 이상 질환을 유발할 수 있고 진핵생물 유성생식과 진화에 필수적인 과정이다. - 세포 과정 - 괴사
괴사는 세포 손상으로 인해 생체 내에서 조절 없이 일어나는 세포 사멸의 한 형태로, 응고괴사, 액화괴사 등 다양한 유형으로 분류되며 허혈, 감염 등 여러 원인에 의해 발생하고 벌거숭이두더지쥐처럼 세포자멸사 대체 기전으로 활용되기도 한다.
2. 염색체 교차
유성 생식을 하는 생물의 정자 또는 난자와 같은 생식자는 감수 분열을 통해 생성된다. 감수분열 과정에서 한 쌍으로 이루어진 염색체는 유전자 교차가 일어나 유전자를 재조합한 후 네 개의 생식자로 나뉜다. 그 결과 자식 세대로 전달되는 유전자는 상동성을 갖고 있으나 각각 서로 다른 유전형질을 갖게 되는 유전적 변이가 발현된다.[6]
진핵생물에서 감수 분열 동안의 재조합은 염색체 교차에 의해 촉진된다. 염색체 교차는 부모로부터 각각 물려받은 짝을 이룬 염색체 사이의 재조합을 포함하며, 일반적으로 감수 분열 동안 발생한다. 제1분열 전기 (파키텐기) 동안, 네 개의 사용 가능한 염색 분체는 서로 빽빽하게 형성된다. 이러한 형성 동안, 두 염색 분체의 상동성 부위는 서로 가깝게 쌍을 이루어 유전 정보를 교환할 수 있다.[6]
두 유전형질이 유전자에서 서로 가깝게 위치하고 있을 경우 유전자 교차가 발생하더라도 분리될 가능성은 적어지기 때문에 유전자 연관이 나타난다. 때문에 염색체 접합은 같은 염색체에 존재하는 대립형질의 상관 관계를 무너뜨린다.
염색체 교차가 한 쌍의 염색체를 실제로 뒤섞는 과정은 유전자 전환이라고 한다. 유전자 전환은 한 쪽의 유전자 배열을 참조하여 다른 쪽의 유전자 배열 일부를 바꾸는 과정이다.
2. 1. 재조합 빈도와 유전자 지도
유성 생식을 하는 생물의 생식자는 감수 분열 과정을 통해 생성되는데, 이때 한 쌍의 염색체는 유전자 교차를 통해 유전자를 재조합한 후 네 개의 생식자로 나뉜다. 두 유전형질이 유전자에서 서로 가깝게 위치하면 유전자 교차가 일어나도 분리될 가능성이 적어 유전자 연관이 나타난다. 염색체 접합은 같은 염색체에 있는 대립형질의 상관 관계를 무너뜨린다.[6]진핵생물에서 감수 분열 동안의 재조합은 염색체 교차에 의해 촉진된다. 염색체의 임의의 위치에서 재조합이 일어날 확률이 작기 때문에, 두 위치 사이의 재조합 빈도는 그 사이의 거리에 따라 달라진다. 따라서, 동일한 염색체 상에서 충분히 멀리 떨어진 유전자의 경우, 교차의 양이 충분히 높아 대립 유전자 간의 상관 관계를 파괴한다.[7]
두 유전자가 서로 가까이 있을수록 더 멀리 떨어져 있는 유전자보다 분리될 가능성이 낮기 때문에, 유전학자들은 교차 빈도를 알면 두 유전자가 염색체에서 대략 얼마나 떨어져 있는지 추론할 수 있다. 재조합 동안 일반적으로 함께 유지되는 유전자를 유전자 연관이라고 한다. 연관된 쌍의 한 유전자는 때때로 다른 유전자의 존재를 추론하기 위한 마커로 사용될 수 있다.[7]
두 로커스 사이에서 관찰되는 재조합 빈도는 ''교차 값''이다. 이는 두 개의 연관된 유전자 로커스 (유전적 마커) 사이의 염색체 교차 빈도이며, 관찰된 유전적 로커스 사이의 거리에 따라 달라진다. 유전자형 및 환경 조건이 고정된 경우, 연관 구조 (염색체)의 특정 영역에서 재조합은 일정하게 유지되는 경향이 있으며, 이는 유전자 지도를 만드는 데 사용되는 교차 값에도 적용된다.[5][8]
염색체 상에 있는 두 쌍의 유전자좌 사이에서 재조합이 일어날 확률을 재조합가(또는 재조합 확률, recombination rate영어)라고 한다. 몇몇 모델 생물에서 게놈의 전체 염기 서열이 결정된 결과, 유전적 재조합가에 기반한 유전학적 지도상의 거리와 염색체상의 물리적인 거리가 반드시 상관하지 않는다는 것이 밝혀졌지만, 현재에도 유전적 재조합의 결과를 추정할 때 유용한 지표가 되고 있다.
한쪽 부모로부터 유래한 유전자좌 상의 대립 유전자가 할아버지로부터 유래한 경우, 할머니로부터 유래한 경우로 정의할때, 일 때, 유전자좌 와 유전자좌 사이에 재조합이 일어났다고 한다. 따라서 재조합 확률 θ 는 다음과 같이 정의된다.
:
특정 가계 샘플에서 재조합을 완전히 관찰할 수 있다고 가정했을 때, 재조합가(%)를 l, 재조합이 일어난 배우자 수를 m, 모든 배우자 수를 n이라고 하면, 재조합가는 다음 식으로 추정할 수 있다.
:
재조합가 l = 0% 일 때를 완전 연쇄, 0% < l < 50% 일 때를 불완전 연쇄, l = 50% 일 때를 독립이라고 한다. 염색체의 교차는 두 개의 염색체 사이에서만 일어나며, 다른 염색체 간에서는 일어나지 않는다. 따라서 정의상 재조합가가 50%를 초과하는 일은 있을 수 없다.
여기서 재조합 값을 θ라고 한다. 특정 두 개의 유전자좌 사이에서 교차가 일어나는 것은 매우 드문 현상이라고 생각되므로, 이것이 푸아송 분포를 따른다고 가정한다. 이 확률의 기대값은 상기 가설에 따르면, 이 유전자좌 사이의 거리와 상관관계가 있다고 생각되며, 이것을 x라고 한다. 즉, c번의 교차가 일어날 확률은 다음과 같이 나타낼 수 있다.
:
재조합이 일어났다는 것은, 홀수 번의 교차가 일어났음을 나타낸다. 즉,
:
여기서 sinh는 쌍곡선 함수 중 하나이다. 즉,
:
이것은 홀든의 맵 함수로 알려져 있으며, 두 유전자좌 사이의 '''유전적 거리'''를 나타낸다. x의 단위는 모르간(M)으로, 1 M의 거리에 있는 유전자좌 사이에서는 1번의 전달당 1번의 교차가 생길 것으로 예상된다. 이것은 매우 긴 거리에 해당하며, 보통 1/100 M = 1 cM(센티모르간)의 단위가 자주 사용된다. 이것을 이용하여 염색체 상의 유전자의 배치 위치의 유전자 지도를 그릴 수 있다.
게놈 상에서 특히 재조합이 일어나기 쉬운 장소를 재조합 핫스팟이라고 한다. 인간 게놈에서는 전체 게놈 상의 재조합 핫스팟 분포가 확인되었다. HapMap[40]의 2단계 데이터에 따르면 인간 게놈 상에 32,966개의 재조합 핫스팟이 존재한다는 것을 알게 되었다[41]。특정 염색체에 재조합 핫스팟이 많다는 것은 없다.
재조합은 연쇄를 약화시키는 주요 원인이며, 재조합이 존재한다는 사실 자체가 연쇄 분석을 성립시킨다.
3. 상동 재조합
상동 재조합은 염색체에서 상동성이 있는 DNA 사이에서 일어나는 현상이다. 감수 분열 과정에서 염색체의 교차가 일어날 때 주로 발생하지만, 체세포 분열에서도 나타날 수 있다.
상동 재조합은 DNA 손상을 복구하고 유전적 다양성을 높이는 중요한 역할을 한다. 예를 들어 자외선, X-선 같은 외부 요인이나, 세포 내 반응성 산소 종에 의해 발생하는 DNA 손상은 상동 재조합 복구(HRR)를 통해 복구된다.[10][11] 사람의 경우, 감수 분열 시 상동 재조합에 필요한 유전자에 결함이 생기면 불임이 발생할 수 있고,[12] BRCA1, BRCA2와 같이 상동 재조합에 필요한 유전자에 문제가 생기면 암 발생 위험이 커진다.[11]
세균의 형질전환은 같은 종의 세균 세포 사이에 DNA가 전달되는 과정이다. 이 과정은 상동 재조합을 통해 공여 DNA를 수용체 염색체에 통합하는 방식으로 진행되며, DNA 손상을 복구하는 적응 기작으로 볼 수 있다.[13] 병원성 세균은 숙주 감염과 관련된 염증, 산화 환경에서 발생하는 DNA 손상을 복구하여 생존에 유리하게 작용할 수 있다.
바이러스의 경우, 둘 이상의 바이러스가 같은 숙주 세포를 감염시켰을 때, 바이러스 게놈끼리 쌍을 이루어 상동 재조합을 일으켜 생존 가능한 자손을 만들 수 있다. 이를 다중 재활성화라고 하며, 람다 및 T4 파지 등에서 연구되었다.[14]
상동 재조합 반응을 촉매하는 효소를 리콤비네이스(재조합 효소)라고 한다. 대장균을 포함한 진정세균에서는 RecA가 DNA 복구 및 외래 DNA 섭취에 관여한다. RecA는 DNA 이중 가닥 절단(DSB) 복구에 중요하다. 대장균에서 DNA 이중 가닥 절단이 발생하면, RecBCD 복합체가 절단 부위 말단을 인식하고 소화하여 단일 가닥 DNA를 생성한다. RecA 단백질은 단일 가닥 DNA에 결합하여 중합, 신장되어 뉴클레오단백질 필라멘트를 형성하고, 상동 영역을 찾아 재조합 반응을 일으킨다.
효모나 사람을 포함하는 진핵생물에는 두 종류의 리콤비네이스가 알려져 있다. Rad51은 체세포 분열 및 감수 분열에서의 상동 재조합에 필요하며, Dmc1은 감수 분열 시 상동 재조합에 특이적으로 기능한다. 진핵생물에서는 DNA 이중 가닥 절단 말단이 Mre11/Rad50/Nbs1 (Xrs2) 복합체에 의해 인식되고, 이후 복구 방식이 제어된다. 상동 재조합을 통한 복구 시에는 단일 가닥 DNA 영역이 생성되고, RPA에 의해 안정화된다. 이후 Rad52 등의 단백질이 RPA를 제거하고 Rad51을 배치하여 RecA와 유사한 필라멘트를 형성, 상동 재조합 반응을 일으킨다.
상동 재조합이더라도, 염색체의 다른 위치 사이에서 재조합이 일어나면 좌위의 수가 변할 수 있다. 유전자가 포함된 범위에서 이러한 현상이 발생하면 유전자 중복 또는 결실로 이어지는데, 이를 비등 재조합 또는 비등 교차라고 한다.
3. 1. 비상동 말단 연결
비상동 말단 연결은 서로 상동성이 없는 DNA 서열 사이에서 일어나는 재조합이다. 염기 서열 상동성이 없는 DNA 서열 사이에서도 재조합이 발생할 수 있는데, 이는 염색체 전좌를 유발하여 암으로 이어지기도 한다. 프로파지 DNA가 염색체에서 빠져나갈 때(잘려져서 새로운 파지를 만들 때) 비상동 재조합이 일어날 수 있으며, 이 경우 숙주의 유전자를 포함한 파지(형질도입 파지)가 생성된다.4. 세균의 유전자 재조합
세균은 형질전환, 형질도입, 접합과 같은 주요 방식을 통해 유전자 재조합을 수행한다.[2][3][4][5]
- 형질전환: 주변 환경으로부터 외부 DNA를 섭취한다.
- 형질도입: 바이러스가 매개하는 세균 간 DNA 전달 과정이다.
- 접합: 세포 간 접촉을 통해 한 세균에서 다른 세균으로 DNA를 전달한다.
DNA 가닥이 표적 세포로 전달되지만, 표적 세포가 분열할 때 복제되지 못하는 경우도 있는데, 이를 중단된 전달이라고 한다.
4. 1. 부위 특이적 재조합
박테리오파지(파지)에 의한 부위 특이적 재조합에서는 파지의 DNA가 재조합과 유사한 방법으로 숙주인 세균의 염색체 DNA에 통합된다. 파지 DNA의 부분 서열이 표적 DNA의 서열과 완전히 일치하면 인테그라제라고 불리는 특수한 재조합 효소가 파지 DNA를 표적에 통합한다. 이처럼 파지 DNA가 염색체에 통합된 상태를 프로파지라고 한다.5. 면역계의 유전자 재조합
면역계의 B 세포에서는 면역 글로불린 항체급 재조합이라는 유전자 재조합이 일어난다. 이는 면역 글로불린 항체의 종류를 바꾸어 새로운 항체를 만드는 과정에서 일어난다. 예를 들어 B세포의 면역 글로불린 M을 다른 아형인 면역 글로불린 G로 바꾸면 그에 따라 새로운 항체가 형성된다. 면역글로불린 클래스 스위칭이라고도 불리는 이 과정은 항체의 클래스를 변경하는 생물학적 메커니즘이다.[1]
생리적으로 일어나는 재조합에는 림프구의 B 세포에서 일어나는 면역 글로불린 유전자 재조합과 T 세포에서 일어나는 T 세포 수용체 유전자 재조합이 있다. 이것은 항체나 면역 반응에서의 기능적 다양성에 필수적인 과정이다.[2]
6. 유전자 재조합 기술
재조합 DNA를 만들기 위해서는 재조합할 목적 DNA, DNA 운반체(벡터), 제한 효소, 연결 효소(리게이스)가 필요하다. DNA 운반체는 목적 DNA를 숙주 세포로 운반하는 역할을 하며, 숙주 세포는 재조합 DNA를 이식받을 살아 있는 세포이다. 숙주 세포로는 대장균이 주로 이용된다. 대장균은 분자생물학적 정보가 충분히 밝혀져 있어 유전자 조작과 전체 대사 조절이 용이하고 배양과 보존이 간편하기 때문에 재조합 DNA의 숙주 세포로 자주 사용된다.[42]
제한 효소는 세균과 같은 미생물에서 발견되며, 특정 염기 서열을 인식하여 DNA를 작은 절편으로 자른다. 제한 효소에는 여러 종류가 있으며 종류에 따라 인식하는 염기 서열이 다르다. 제한 효소로 잘린 DNA의 양쪽 말단은 단일가닥 DNA가 되어 상보적 염기서열을 가진 다른 DNA 말단과 결합할 수 있는 점착성 말단이 된다.[42]
목적 DNA와 DNA 운반체를 같은 제한 효소로 자르면 그 말단이 상보적으로 결합할 수 있다. 같은 제한 효소로 자른 목적 DNA와 DNA 운반체를 연결 효소로 연결하면 재조합 DNA가 된다.[42]
대장균의 플라스미드를 활용한 유전자 재조합 기술을 이용하여 최초로 대량 생산된 의약품은 인슐린이다.[42]
인슐린 생산 과정에서 재조합 DNA를 대장균에 넣어 증식시키면 재조합 DNA가 복제되어 동일한 DNA를 여러 개 얻을 수 있다. 이처럼 동일한 DNA를 만들어 내는 것을 DNA 클로닝이라고 한다. DNA 클로닝을 통해 복제된 DNA는 유전자에 대한 기초 연구에 이용되거나, 형질전환 생물과 인슐린, 성장 호르몬 등 의학적으로 사용되는 단백질을 생산하는 데 이용된다.[42]
유전자 재조합 과정에서는 플라스미드를 제한 효소로 자르고 목적 DNA를 삽입하는 단계에서 일부 플라스미드는 목적 DNA가 삽입되지 않고 그냥 봉합된다. 또한, 재조합 플라스미드를 숙주 세포로 도입하는 단계에서 일부 숙주 세포에는 플라스미드가 들어가지 않는다. 그 결과 숙주 세포는 플라스미드가 도입되지 않은 것, 재조합되지 않은 플라스미드가 도입된 것, 재조합 플라스미드가 도입된 것의 3종류가 생성된다. 따라서 목적 DNA를 클로닝하기 위해서는 재조합 플라스미드가 도입된 숙주 세포를 선별하는 과정이 필요하다.[42]
재조합 플라스미드를 가진 숙주 세포를 선별하는 방법 중 하나는 항생제에 내성을 가진 유전자와 lacZ 유전자를 이용하는 것이다. lacZ 유전자는 젖당 분해 효소를 만드는 유전자인데, 여기서 만들어진 젖당 분해 효소는 X-gal이라는 물질을 분해하여 푸른색을 띠는 부산물을 만들기 때문에 이 유전자를 가진 대장균을 쉽게 선별할 수 있다.[42]
플라스미드에는 항생제의 일종인 앰피실린에 저항성을 갖게 하는 유전자가 있기 때문에, 사용하는 대장균을 앰피실린이 포함된 배지에서 배양하여 플라스미드가 없는 대장균은 성장하지 못하고 재조합되지 않은 플라스미드를 가진 대장균과 재조합 플라스미드를 가진 대장균만 군체(콜로니)를 형성한다.[42]
재조합되지 않은 플라스미드를 가진 대장균과 재조합 플라스미드를 가진 대장균은 군체의 색깔로 구별한다. 유전자 재조합 과정에서 목적 유전자를 플라스미드의 젖당 분해 효소 유전자 부위에 삽입하면, 재조합되지 않은 플라스미드를 가진 대장균은 젖당 분해 효소를 생산하지만, 재조합 플라스미드를 가진 대장균은 젖당 분해 효소 유전자가 잘려 있어 젖당 분해 효소를 생산하지 못한다. 두 종류의 대장균을 젖당 분해 효소에 의해 푸른색으로 변하는 배지에서 배양하면 재조합되지 않은 플라스미드를 가진 대장균의 군체는 젖당 분해 효소로 X-gal을 분해하여 만들어진 부산물에 의해 푸른색으로, 재조합 플라스미드를 가진 대장균의 군체는 흰색으로 나타나 두 대장균을 구별할 수 있다.[42]
플라스미드를 가지고 있지 않은 식물에 박테리아의 플라스미드를 운반체로 이용하여 유전자 변형 식물을 개발할 수도 있다. 토양 미생물의 일종인 아그로박테리아의 Ti 플라스미드 속 T DNA에 유용한 유전자를 삽입한 채 운반체로 이용하면 유전자 변형 식물의 제작이 가능하다. Ti 플라스미드 속 유전자가 식물의 DNA로 전이되어 식물이 유용한 단백질을 생산할 수 있게 하는 것이다.[42]
플라스미드를 활용한 식물의 유전자 변형을 통해 잡초의 유전자를 벼의 유전자에 삽입하여 냉해와 가뭄 등 악조건에 대한 저항력을 기르도록 하거나, 벼나 감자, 옥수수, 콩 등의 당도를 높이고 병충해에 강하도록 개발할 수 있다. 또한 농산물을 적은 노동력과 생산 비용으로 수확할 수 있도록 하거나 식물에게 질소 고정 능력을 부여하는 것이 가능하며, 꽃의 색을 달리할 수도 있다.[42]
유전자 재조합에서 재조합은 서로 다른 유기체에서 유래한 다양한 DNA 조각을 인위적이고 의도적으로 재조합하여 재조합 DNA를 생성하는 것을 의미할 수도 있다. 유전자 재조합의 이러한 사용의 주요 예는 유기체의 유전자를 추가, 삭제 또는 변경하는 데 사용할 수 있는 유전자 표적화이다. 이 기술은 특정 유전자의 효과를 연구할 수 있게 해주므로 생의학 연구자에게 중요하다. 유전자 재조합에 기반한 기술은 또한 생물학적 관심이 있는 새로운 단백질을 개발하기 위해 단백질 공학에 적용된다.
예시로는 제한 효소 매개 통합, 깁슨 어셈블리 및 골든 게이트 클로닝 등이 있다.
7. RNA 바이러스의 재조합
RNA 바이러스는 최소 두 개의 바이러스 게놈이 동일한 숙주 세포 내에 존재할 때 유전자 재조합이 가능하다.[19][20] 재조합은 RNA 바이러스 다양성과 면역 회피에 상당 부분 기여한다.[21] RNA 재조합은 피코르나바이러스 ((+)ssRNA) (예: 소아마비 바이러스)에서 게놈 구조와 바이러스 진화 과정을 결정하는 주요 원동력으로 보인다.[22] 레트로바이러스 ((+)ssRNA) (예: HIV)에서 RNA 게놈 손상은 재조합의 한 형태인 가닥 전환을 통해 역전사 동안 회피되는 것으로 보인다.[23][24]
레오바이러스 (dsRNA) (예: 레오바이러스), 오르토믹소바이러스 ((-)ssRNA) (예: 인플루엔자 바이러스)[1] 및 코로나바이러스 ((+)ssRNA) (예: SARS)에서도 재조합이 발생한다.[25][26]
RNA 바이러스의 재조합은 게놈 손상에 대처하기 위한 적응으로 보인다. 게놈 복제 중 템플릿 가닥 간의 전환은 복제 선택 재조합이라고 하며, 이는 원래 DNA 게놈을 가진 유기체에서 짧은 거리에서 재조합 사건의 긍정적인 상관관계를 설명하기 위해 제안되었다.[27]
(+)ssRNA 게놈을 복제할 때, 소아마비 바이러스의 RNA 의존성 RNA 중합 효소 (RdRp)는 재조합을 수행할 수 있다. 재조합은 RdRp가 음성 가닥 합성을 하는 동안 (+)ssRNA 템플릿을 전환하는 복제 선택 메커니즘에 의해 발생하는 것으로 보인다.[29] RdRp 가닥 전환에 의한 재조합은 (+)ssRNA 식물 카모바이러스 및 톰부스바이러스에서도 발생한다.[30]
동일 종이지만 서로 다른 계통의 동물 바이러스 사이에서 재조합은 드물게 발생할 수 있으며, 그 결과 발생하는 재조합 바이러스는 때때로 인간에게 감염 발병을 일으킬 수 있다.
특히 코로나바이러스의 경우, 템플릿 전환에 의해 형성되는 서브게놈 mRNA를 포함하는 특징적인 전사 메커니즘으로 인해, 진화적으로 먼 관련이 있는 그룹(아속) 사이에서도 재조합이 발생할 수 있다.[28][26]
재조합은 코로나바이러스 내의 유전적 변동성을 결정하는 주요 원동력일 뿐만 아니라 코로나바이러스 종이 숙주 간에 이동하고 드물게 새로운 종이 출현하는 능력에도 영향을 미치는 것으로 보이지만, 재조합 메커니즘은 불분명하다.[1] 2020년 초, 호주 SARS-CoV-2 분리주의 많은 게놈 서열에서 s2m에 결실 또는 돌연변이(29742G>A 또는 29742G>U; "G19A" 또는 "G19U")가 나타났으며, 이는 RNA 재조합이 이 RNA 요소에서 발생했을 수 있음을 시사한다. 29742G("G19"), 29744G("G21") 및 29751G("G28")는 재조합 핫스팟으로 예측되었다.[31] COVID-19 팬데믹 초기 몇 달 동안, 이러한 재조합 사건이 SARS-CoV-2가 인간을 감염시키는 능력의 진화에 중요한 단계였을 것으로 추정되었다.[32] 연관 불평형 분석 결과, 11083G > T 돌연변이를 가진 RNA 재조합 또한 바이러스 자손의 돌연변이 증가에 기여했다는 것이 확인되었다. 이 발견은 SARS-CoV-2의 11083G > T 돌연변이가 다이아몬드 프린세스 호 내 격리 기간 동안 확산되었으며 양성 선택 압력 하에서 de novo RNA 재조합을 통해 발생했음을 나타낸다. ''다이아몬드 프린세스'' 크루즈에 탑승한 세 명의 환자에서, 두 개의 돌연변이 29736G > T 및 29751G > T (G13 및 G28)는 SARS-CoV-2의 코로나바이러스 3′ 줄기-루프 II-유사 모티프 (s2m)에 위치했다. s2m은 많은 코로나바이러스 종 사이에서 3' 비번역 영역에서 고도로 보존된 RNA 모티프로 간주되지만, 이 결과는 SARS-CoV-2의 s2m이 RNA 재조합/돌연변이 핫스팟임을 시사한다.[33]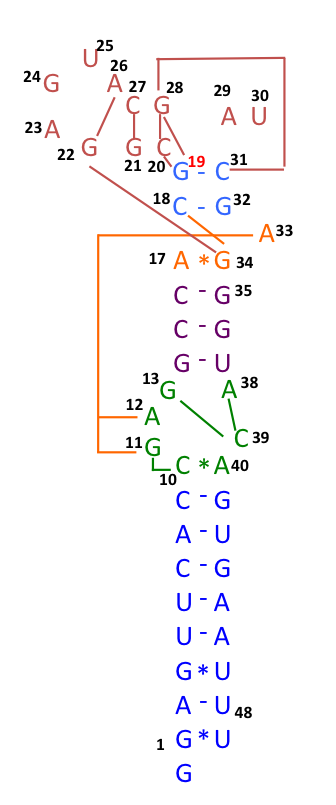
참조
[1]
논문
Interchromosomal recombination in the extremely radioresistant bacterium Deinococcus radiodurans.
1995-10-01
[2]
서적
Uvod u genetičko inženjerstvo i biotehnologiju
Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo
[3]
서적
Molecular Biology of the Cell
Garland Science
[4]
서적
Dictionary of genetics
https://archive.org/[...]
Oxford University Press
[5]
서적
Glossary of genetics and cytogenetics: Classical and molecular
https://archive.org/[...]
Springer-Verlag
[6]
서적
Molecular Biology of the Cell, Fourth Edition
Garland Science
[7]
웹사이트
Access Excellence
http://www.accessexc[...]
The National Health Museum Resource Center
2011-02-23
[8]
서적
Dictionary of Genetics.
Oxford University Press
1998
[9]
서적
The Encyclopedia of Molecular Biology
Blackwell Science
1994
[10]
논문
Genetic controls of meiotic recombination and somatic DNA metabolism in Drosophila melanogaster
1976-11-01
[11]
서적
DNA Repair Mechanisms
Academic Press
1978
[12]
논문
Expression of somatic DNA repair genes in human testes
2007-04-01
[13]
논문
Adaptive value of sex in microbial pathogens
http://www.hummingbi[...]
2008-05-01
[14]
논문
Deoxyribonucleic acid repair in bacteriophage
1981-03-01
[15]
논문
Meiotic versus mitotic recombination: two different routes for double-strand break repair: the different functions of meiotic versus mitotic DSB repair are reflected in different pathway usage and different outcomes
2010-12-01
[16]
논문
Temporal Analysis of Meiotic DNA Double-Strand Break Formation and Repair in Drosophila Females
[17]
논문
The evolution of sex dimorphism in recombination
2003-02-01
[18]
논문
Genome-wide maps of recombination and chromosome segregation in human oocytes and embryos show selection for maternal recombination rates
2015-07-01
[19]
논문
How RNA viruses maintain their genome integrity
2010-06-01
[20]
논문
Why do RNA viruses recombine?
2011-08-01
[21]
논문
Recombination is required for efficient HIV-1 replication and the maintenance of viral genome integrity
2018-11-01
[22]
논문
Recombination in Enteroviruses, a Multi-Step Modular Evolutionary Process
2019-09-01
[23]
논문
Retroviral recombination and reverse transcription
1990-11-01
[24]
논문
Sex in microbial pathogens
2018-01-01
[25]
논문
Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses
2016-06-01
[26]
논문
The neighborhood of the Spike gene is a hotspot for modular intertypic homologous and non-homologous recombination in Coronavirus genomes
https://academic.oup[...]
2021-10-12
[27]
논문
On the mechanism of intragenic recombination. I. The rII region of bacteriophage T4.
1962
[28]
논문
Evaluation of a recombination-resistant coronavirus as a broadly applicable, rapidly implementable vaccine platform
2018-12-01
[29]
논문
The mechanism of RNA recombination in poliovirus
1986-11-01
[30]
논문
Mechanism of RNA recombination in carmo- and tombusviruses: evidence for template switching by the RNA-dependent RNA polymerase in vitro
2003-11-01
[31]
논문
Emerging viral mutants in Australia suggest RNA recombination event in the SARS-CoV-2 genome
2020-07-01
[32]
bioRxiv
Synonymous mutations and the molecular evolution of SARS-Cov-2 origins
2020-10-12
[33]
논문
Viral transmission and evolution dynamics of SARS-CoV-2 in shipboard quarantine
2021-07-01
[34]
논문
Emergence of SARS-CoV-2 through recombination and strong purifying selection
2020-07-01
[35]
논문
Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic
2020-11-01
[36]
논문
Recombination should not be an afterthought
2020-11-00
[37]
논문
Prevolutionary dynamics and the origin of evolution
2008-09-30
[38]
논문
A Case for the Extreme Antiquity of Recombination
[39]
논문
Spontaneous advent of genetic diversity in RNA populations through multiple recombination mechanisms
[40]
웹사이트
국제 HapMap 계획
http://hapmap.ncbi.n[...]
[41]
논문
A second generation human haplotype map of over 3.1 million SNPs
[42]
서적
2015 개정 교육과정 생명과학2 교과서
비상, 교학사
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

